- Страна производительРоссия
Химические реагенты
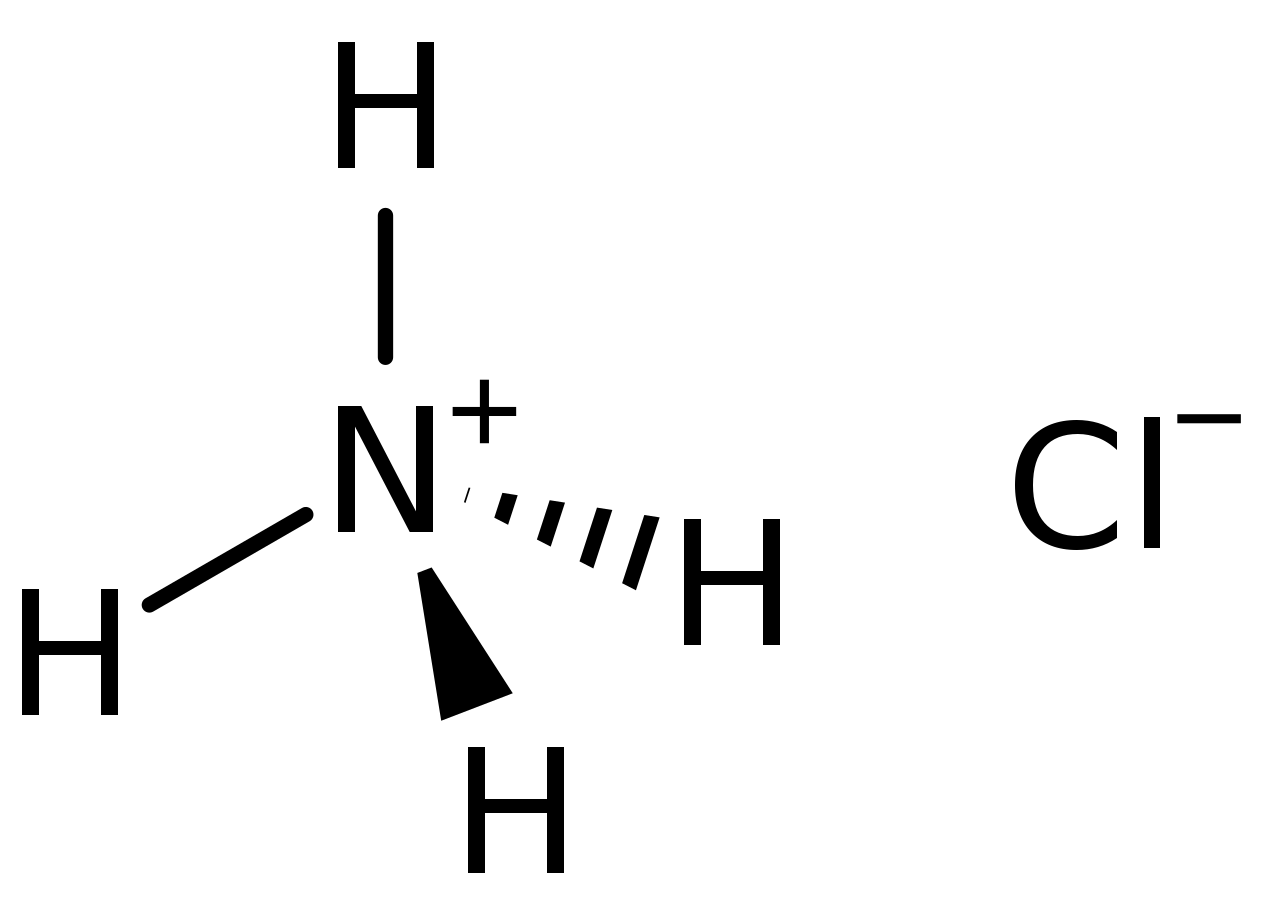
Хлорид аммония (хлористый аммоний; техническое название — нашаты́рь) — неорганическое соединение, соль аммония с химической формулой NH4Cl, белый кристаллический слегка гигроскопичный порошок без запаха.
В природе хлорид аммония представлен минералом нашатырь, от араб. ﻧﺸﺎﺩﺭ (nūšādir) — «аммиак».
Физические свойства
Бесцветные или белые кристаллы кубической сингонии (а = 0,38758 нм, z = 1, пространственная группа Pm3m). Относительная плотность 
Хорошо растворим в воде (37,2 г / 100 мл), жидком аммиаке. Водные растворы вследствие гидролиза имеют слабокислую реакцию. Температура кипения насыщенных водных растворов 116 °C.
Растворимость (безводного вещества в безводном растворителе): в этаноле — 0,6 г/100 г, в метаноле — 3,3 г/100 г.
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Химические свойства
- реагирует с щелочами с выделением аммиака:

- реагирует с нитратом серебра с выпадением белого осадка хлорида серебра, темнеющего при действии света:

- реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:

- под действием электрического тока разлагается с образованием хлористого азота
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.

В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:

Реакция взаимодействия аммиака и соляной кислоты:

Компании ТОО "Industrial Deliveries Company" мы предлагаем товары для промышленности, аналитической и промышленной химии, и многое другое. У нас в каталоге вы сможете найти широкий выбор качественных товаров: Лабораторные приборы, Лабораторную посуду, Химические реагенты, Товары для промышленности, Муфельные печи и сушильные шкафы, Измерительное оборудование. Осуществляем доставку по всем странам и регионам СНГ. Гарантия качества и лучшей цены. Подробнее по телефону: +7 777 783 13 00.

 Самовывоз
Самовывоз почтой
почтой Транспортная компания
Транспортная компания
 Счет на оплату
Счет на оплату Наличными
Наличными















